Динамика уровня эндогенного и экзогенного NO в тканях раны и органах животных (ЭПР-спектроскопическое исследование)
Целью исследований явилось: 1) впервые количественно оценить уровень эндогенного NO в тканях раны, а также параллельно – в печени, кишечнике, почках, сердце и крови; 2) используя источник экзогенного газообразного NO (аппарат «ПЛАЗОН»), выяснить возможность переноса его через раневую поверхность, неповрежденную кожу и мягкие ткани; 3) исследовать динамику изменения уровня NO в организме после воздействия на рану экзогенным NO.
Для решения поставленных задач использовали модель полнослойной плоскостной раны площадью 300 мм2. На 5-е сутки для ЭПР-измерений уровня NO животным вводили «ловушку» оксида азота – диэтилтиокарбамат (ДЭТК), после чего их декапитировали и отбирали образцы крови, грануляционной ткани (с частью мышечной) из дна раны и внутренних органов (сердце, печень, почка, тонкий кишечник).
У части животных на 5 сутки после нанесения раны проводили ее обработку NO-содержащим газовым потоком (NO-СГП) аппарата «ПЛАЗОН». Содержание NO в газовом потоке – 500-800 ppm. Все животные были изолированы от прямого вдыхания газовой смеси. Всего на 52 животных было выполнено 6 серий опытов, которые различались временем воздействия NO и временем от его окончания до эвтаназии животного.
В результате ЭПР-исследования, выполненного на 12 крысах без воздействия NO-СГП, в тканях раны, печени, кишечника и сердца регистрировались однотипные спектры ЭПР, обусловленные МНКЖ-ДЭТК. Концентрация этих комплексов в тканях раны варьировала от 7 до 13 µМ и составляла в среднем 10,3±2,3 µМ. Инкубация образцов ткани в 20 мМ растворе аскорбиновой кислоты в течение 20 минут приводила к увеличению интенсивности сигнала ЭПР МНКЖ-ДЭТК в среднем в 3,5 раза. Это свидетельствовало о резком увеличении содержания эндогенного NO в тканях раны, т.к. в подкожной клетчатке и мышцах интактных животных концентрация комплексов составляла лишь 0,016±0,004 µМ. В печени крыс, имеющих рану, концентрация МНКЖ-ДЭТК составляла 2,3±1,4 µМ. У контрольных животных (без раны) интенсивность ЭПР-сигналов этих комплексов была значительно ниже, всего 0,06±0,002 µМ. ЭПР-сигнал МНКЖ-ДЭТК в почках и сердце несущественно превышал уровень сигнала контрольных животных. Кроме того, в образцах тканей раны и сердца обнаруживался сигнал нитрозильных комплексов гемопротеидов - гемоглобина и миоглобина. В крови опытных животных концентрация нитрозильных комплексов гемоглобина составляла 23,0±7,0 µM , что соответствовало 0,16% от всего имеющегося гемоглобина. Одинаковая по массе с образцом крови навеска тканей раны содержала 60-70 % нитрозогемопротеидов по отношению к их содержанию в крови. Введение животным ингибитора NOS – нитроаргинина – в дозе 16мг/кг за 30 мин до введения «ловушки» NO приводило к резкому снижению сигнала ЭПР МНКЖ-ДЭТК в тканях раны и печени - до 9-12% и 16-22% от уровня контроля соответственно.
Для исследования возможности проникновения экзогенного газообразного NO через неповрежденные ткани брюшной стенки крыс использовали наркотизированных животных без раны на спине. Обработку оксидом азота, продуцируемым аппаратом «ПЛАЗОН», проводили в течение 60 и 180 секунд. В зависимости от времени экспозиции наблюдалось примерно линейное соотношение между количеством образующихся МНКЖ-ДЭТК и оксидом азота в печени и крови животных. Через 2 мин после завершения 180-секундной обработки максимальный сигнал регистрировали в кишечнике (в 2,6 выше, чем у контрольных животных), в печени, почках и сердце он также превышал контрольные значения в 1,7 раз. Эти результаты свидетельствуют о проницаемости неповрежденной кожи и других тканей брюшной стенки для молекул экзогенного NO.
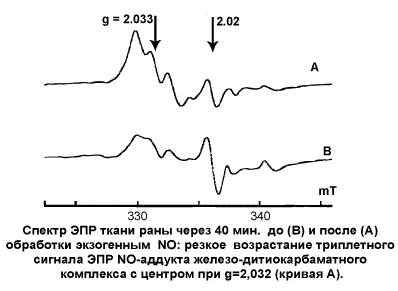 Более сложные соотношения наблюдались при обработке экзогенным NO тканей раны. «Ловушку» вводили за 15 минут до обработки. Если декапитацию животного проводили через 2 минуты после обработки оксидом азота, то при 30, 60 и 180-секундной экспозиции наблюдалось линейное соотношение между дозой газа и количеством МНКЖ-ДЭТК, образующихся в тканях раны. Если животных декапитировали через 30-40 мин после воздействия, то происходил значительный рост ЭПР-сигнала нитрозильных комплексов миоглобина раны и гемоглобина крови – в 10-100 раз по сравнению с 2-х минутным интервалом. При этом ЭПР-сигнал МНКЖ-ДЭТК тканей раны и крови возрастал в 9-11 раз. Через 60 мин наблюдалось снижение интенсивности изучаемых параметров парамагнитных центров в тканях раны и в крови – до 40-60% от их максимального значения.
Более сложные соотношения наблюдались при обработке экзогенным NO тканей раны. «Ловушку» вводили за 15 минут до обработки. Если декапитацию животного проводили через 2 минуты после обработки оксидом азота, то при 30, 60 и 180-секундной экспозиции наблюдалось линейное соотношение между дозой газа и количеством МНКЖ-ДЭТК, образующихся в тканях раны. Если животных декапитировали через 30-40 мин после воздействия, то происходил значительный рост ЭПР-сигнала нитрозильных комплексов миоглобина раны и гемоглобина крови – в 10-100 раз по сравнению с 2-х минутным интервалом. При этом ЭПР-сигнал МНКЖ-ДЭТК тканей раны и крови возрастал в 9-11 раз. Через 60 мин наблюдалось снижение интенсивности изучаемых параметров парамагнитных центров в тканях раны и в крови – до 40-60% от их максимального значения.
Резкое повышение уровня парамагнитных МНКЖ-ДЭТК, а также нитрозильных комплексов гемопротеидов у прооперированных животных через 30-40 минут после их кратковременной обработки газообразным NO требует объяснения. Можно предположить, что это обусловлено образованием пероксинитрита, возникающего в реакции молекул экзогенного NO и анионов супероксида, уровень которого в организме при воспалительных процессах повышается. Известно, что в ответ на прооксидантный стресс организм мобилизует антиоксидантную защиту сначала путем повышения уровня восстановительных агентов (тиолов, аскорбата и др.), а затем уже – путем активации синтеза антиоксидантных ферментов. Возможно, через 30-40 минут после обработки ран NO-СГП активация первого эшелона антиоксидантной защиты обеспечивала значительное снижение уровня супероксидных анионов. Тем самым ослабляется его разрушительное действие на МНКЖ-ДЭТК и нитрозильные комплексы гемопротеидов, что и приводит к повышению их содержания, оцениваемого методом ЭПР. Не исключается и активация NOS с усилением синтеза эндогенного NO.
Эти предположения могут частично объяснить феномен стимуляции путем воздействия экзогенным NO торпидно текущего раневого процесса, когда имеется дефицит эндогенного NO и избыток свободных радикалов, в том числе и супероксид-анионов.